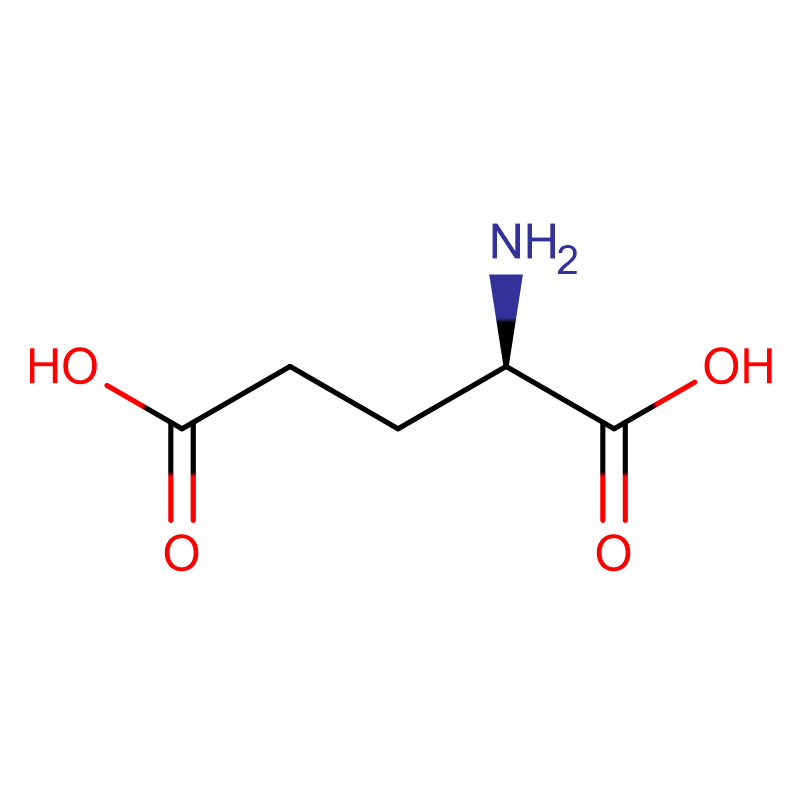
D-glutaminska kislina CAS:6893-26-1 99 % bel prah
| Kataloška številka | XD90313 |
| ime izdelka | D-glutaminska kislina |
| CAS | 6893-26-1 |
| Molekularna formula | C5H9NO4 |
| Molekularna teža | 147.13 |
| Podrobnosti o shranjevanju | Ambient |
| Usklajena tarifna oznaka | 29224200 |
Specifikacije produkta
| Videz | Bel kristalinični prah |
| Esej | 99% |
| Specifična rotacija | -31 do -32,2 |
| Težke kovine | <10 ppm |
| AS | <1ppm |
| pH | 3 - 3,5 |
| SO4 | <0,020 % |
| Fe | <10 ppm |
| Izguba pri sušenju | <0,20 % |
| Ostanek pri vžigu | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,02 % |
| Stanje rešitve | > 98 % |
γ-Glutamiltranspeptidaze (γ-GT) cepijo γ-glutamil amidno vez glutationa in prenesejo sproščeno γ-glutamilno skupino v vodo (hidroliza) ali akceptorske aminokisline (transpeptidacija).Ti vseprisotni encimi igrajo ključno vlogo pri biosintezi in razgradnji glutationa ter pri razstrupljanju ksenobiotikov.Tukaj poročamo o kristalni strukturi 3Å ločljivosti Bacillus licheniformis γ-GT (BlGT) in njegovem kompleksu z l-Glu.Rentgenske strukture potrjujejo, da BlGT pripada superdružini N-terminalne nukleofilne hidrolaze, in razkrivajo, da ima protein odprto razcepko aktivnega mesta, podobno tistemu, o katerem poročajo za homologni encim iz Bacillus subtilis, vendar se razlikuje od tistih, opaženih za človeški γ-GT in za γ-GT iz drugih mikroorganizmov.Podatki kažejo, da vezava l-Glu inducira preurejanje C-terminalnega repa velike podenote BlGT in omogoča identifikacijo skupine kislinskih ostankov, ki so potencialno vključeni v prepoznavanje kovinskega iona.Vlogo teh ostankov pri konformacijski stabilnosti BlGT so proučevali s karakterizacijo avtoprocesiranja, encimske aktivnosti, kemične in termične denaturacije štirih novih Ala posameznih mutantov.Rezultati kažejo, da zamenjava Asp568 z Ala vpliva tako na samodejno obdelavo kot na strukturno stabilnost proteina.